2025年1月13日,國家藥監局核查中心重磅發布《細胞治療產品生產檢查指南》(以下簡稱《指南》),這一指南為細胞治療產品領域帶來了重要的規范與指引。一方面,它為細胞治療產品生產企業提供了明確的操作規范和標準,有助于企業提高生產管理水平和產品質量;另一方面,也為監管部門提供了科學、規范的檢查依據,使市場監管更具針對性和有效性。
《指南》從質量管理、廠房與設施設備、物料及產品、生產管理、質量控制、包裝和標簽、產品追溯系統、供者材料與醫療機構管理幾個方面都進行了細致且嚴格的規范。下文將圍繞細胞治療產品的生產工藝及控制、質量控制的相關條例展開解讀,并為生產企業提供泰林系統解決方案,助力企業更好地理解和應用《指南》。
生產工藝及控制
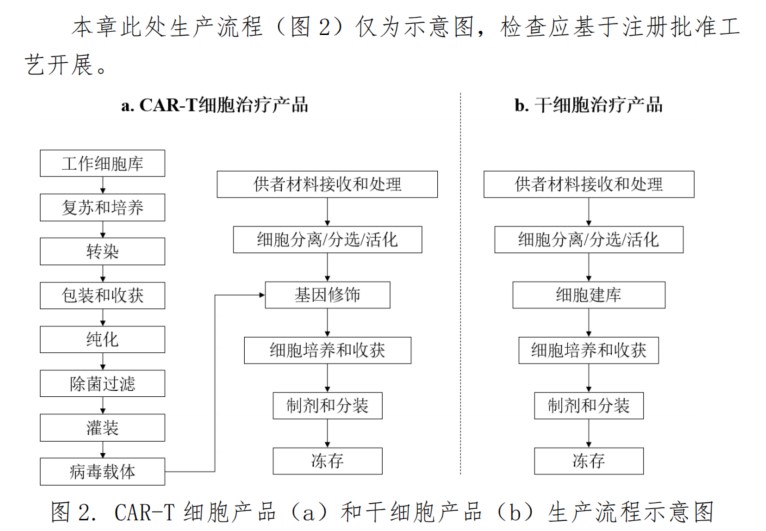
《指南》中列舉了2種細胞產品生產流程示意圖,但不同細胞治療產品工藝存在差異,檢查員應按照注冊批準證明文件批準的工藝開展檢查。需強調的是,細胞治療產品為無菌生產工藝,生產的無菌保證及控制尤其重要。同時,生產過程用到大量一次性無菌耗材,關鍵耗材使用前應確認其完整性,并關注對耗材可見異物的控制措施。


隔離器是細胞治療產品生產的常見設備,是無菌生產的必要條件,《指南》中對隔離器的要求主要包括以下幾個方面:
1、設備構成與內部環境:一般含操作艙和傳遞艙;隔離器內部環境應達到潔凈度級別,關鍵區域有初始氣流保護;
2、性能確認:需對隔離器性能進行確認,確認狀態應與實際生產工藝需求相符合;
3、環境監測:制定環境監測措施,操作艙體內實現在線監測,監測有記錄并可追溯;
4、清潔消毒與檢查:每批次生產前,對隔離器內艙體進行消毒和清潔;定期檢查隔離器的密封完整性;按要求進行手套完整性測試;關注批次間切換的防污染措施及有效性評估;
5、無菌狀態維持時長:應確認隔離器的無菌狀態維持時長。

細胞制備隔離器
泰林細胞制備隔離器是專門用于細胞產品制備,并滿足GMP無菌化生產要求的密閉式集成化操作系統,可代替傳統GMP實驗室,集成細胞分離、激活、修飾、擴增、觀察、收集分裝等功能設備,并為細胞產品提供持續的無菌操作環境。包括全過程潔凈環境、一鍵式正負壓操作模式切換、H2O2消毒、數據實時監控可追溯、21天長時間無菌環境維持等功能,可適配《指南》要求。


蜂巢培養箱是由蜂巢式多工位模塊和配套的培養箱組成,為細胞培養的常用設備,在《指南》中也有較詳細的闡述,主要包括設備構成與內部環境要求、設備電源要求、氣源要求、參數和性能的確認等。

蜂巢式細胞培養系統
泰林蜂巢式細胞培養系統滿足GMP無菌化生產要求,為細胞產品提供高智能化持續的無菌培養環境。蜂巢式細胞培養系統為轉運升降小車和蜂巢式細胞培養站組合,可滿足大規模、多樣本量的細胞培養要求。泰林蜂巢式培養箱箱門為充氣密封形式,對接滅菌采用VHP自動滅菌,培養過程可直接觀察,方形培養箱可實現高空間利用率;配備轉運小車一鍵升降靈活對接,保障全流程無菌。此外,該系統滿足系統控制和環境監控數據實時記錄并儲存、生產培養全過程的數據可追溯、識別每個獨立培養單元并可進行批次管理等功能。
泰林細胞制備隔離器與蜂巢式細胞培養系統組合為泰林細胞制備工作站,專用于細胞產品的培養和制備,符合中國GMP細胞治療產品的附錄、中國GMP無菌產品生產、中國細胞治療產品研究與技術評價指導原則、FDA/EMA/NMPA和ISO/PDA/USA/中國藥典等法規的要求。

質量控制
細胞治療產品是一類“活細胞藥物”,具有起始細胞來源及類型多樣、批次規模小、全程無菌生產、最終制劑成品批量小、臨床使用需求急迫等特點,故細胞治療產品的質量特征有別于其他化學藥品和生物制品。
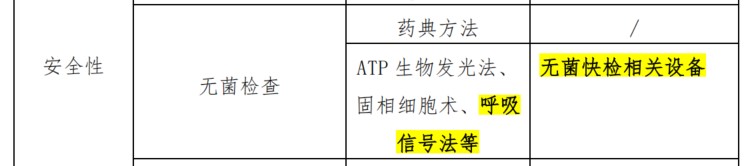
無菌檢查是細胞治療產品的必要質量檢驗項目,其主要檢測方法包括藥典法、ATP生物發光法、固相細胞術和呼吸信號法等。《9406細胞類制品微生物檢查指導原則》中指出,由于細胞治療產品的特殊性,在風險評估的基礎上有條件地采用快速微生物檢查法替代經典無菌檢查法(藥典法)已成為安全性質控的必要手段,該指導原則也將呼吸信號法作為快速微生物檢查的推薦方法。

無菌檢查隔離器
無菌檢查隔離器可為無菌操作提供GMP 環境,相當程度減少微生物污染風險。泰林新一代隔離器產品—TECHLEAD®CST系列無菌隔離器,采用全新一代VHPS滅菌技術,實現過氧化氫濃度和飽和度可控,縮短了傳遞艙和操作艙滅菌時間,創造持續的GMP 潔凈環境;優化氣流處理系統設計,排殘時間縮短;依據GAMP5指南設計的智能化控制系統,新增多項監測參數,具有多級定制化權限控制;可集成如快速滅菌傳遞艙、集菌儀等功能模塊和配置。符合中國GMP和中國藥典以及EUGMP/FDA cGMP/USP-NF要求。

全自動無菌檢查培養系統
泰林全自動無菌檢查培養系統,基于呼吸信號法,是細胞制品快速無菌檢查的優選。該系統可實時監測培養器底部感應器顏色的變化(由微生物代謝產生的CO2引起),計算機系統進行分析并轉換為生長信號,采用專用算法來判斷無菌檢查結果。該系統最快可在8小時內獲得陽性判讀結果;支持直接接種法和薄膜過濾法;2~3個培養室,具有單獨控溫模塊;針對含抗生素類檢品提供專用培養瓶以有效避免假陰性風險。符合中國藥典<9406>細胞類制品微生物檢查指導原則和USP/EP/FDA相關法規要求。
總結
《細胞治療產品生產檢查指南》的正式發布,無疑是細胞治療領域的一個重要里程碑,它為整個行業筑牢了規范基石,從生產到質量把控,指引著細胞治療產品行業走向標準化、科學化。而泰林的一系列系統解決方案都精準契合《指南》要求,為細胞治療產品生產企業提供了有力支持,助力企業在滿足法規標準的同時,不斷提升產品質量與生產效率,共同推動細胞治療產品行業穩健前行。
免責聲明